El columnista Justin Freid explica los conceptos básicos para poner en marcha sus campañas de PPC en la industria altamente regulada de la publicidad de medicamentos recetados.
Una de cada 20 búsquedas en Google está relacionado con la salud. Eso significa que muchos de nosotros nos dirigimos al Dr. Google antes de ir a ver a nuestro médico de atención primaria. Lo que los buscadores no ven es el complejo conjunto de reglas, regulaciones y procesos por los que muchas compañías farmacéuticas deben pasar para aprovechar la búsqueda paga.
Aunque la mayoría está familiarizada con el papel de la FDA a la hora de decidir qué medicamentos están aprobados para su uso, muchos no saben que también supervisa la publicidad de los medicamentos recetados.
Estados Unidos es uno de los pocos países que permite la publicidad directa al consumidor de medicamentos farmacéuticos, y la FDA desempeña un papel clave para asegurarse de que cualquier tipo de publicidad de las marcas farmacéuticas sea precisa y no engañosa. También garantiza que todas las afirmaciones realizadas estén respaldadas con información sobre los posibles efectos secundarios o riesgos.
Para que se lance una campaña SEM, se debe seguir un estricto conjunto de reglas. Muchas de las reglas provienen de la guía de la FDA sobre anuncios recordatorios, mientras que otras son establecidas por equipos legales y regulatorios dentro de las compañías farmacéuticas específicas.
Descripción general de la guía de la FDA
La FDA tiene una amplia guía publicitaria para medicamentos recetados, algunos de los cuales son aplicables a SEM. El problema es que algunas empresas farmacéuticas interpretan de manera diferente algunos puntos dentro de la guía porque las guías son lo suficientemente generales como para aplicarse a múltiples formas de publicidad (creatividad de display, creatividad SEM).
Eso significa que, a medida que se crean formas nuevas e innovadoras de publicidad, la orientación de la FDA a menudo se aplica a estas nuevas oportunidades, incluso si no encaja exactamente. (Nota del editor: la información legal proporcionada en esta columna es solo eso: información legal y no asesoramiento legal.)
A continuación se presentan algunas pautas de la FDA y cómo se aplican al SEM.
Equilibrio justo
Las regulaciones de la FDA requieren que los anuncios farmacéuticos proporcionen un «equilibrio justo» de información sobre los riesgos y beneficios de un medicamento. De acuerdo con la Sitio web de la FDA, «Esto significa que el contenido y la presentación de los riesgos más importantes de un medicamento deben ser razonablemente similares al contenido y presentación de sus beneficios».
Por eso, al final de los comerciales de televisión de medicamentos recetados, a menudo se escucha esa larga lista de efectos secundarios y riesgos. Esto está destinado a contrarrestar la información proporcionada sobre la eficacia del medicamento en el tratamiento de una afección, porque un anuncio no puede poner mayor énfasis en los beneficios que en los riesgos.
Anuncios recordatorios
La definición de la FDA de anuncios recordatorios es como sigue:
Los anuncios recordatorios dan el nombre del medicamento pero no el uso del medicamento. La suposición detrás de los anuncios recordatorios es que la audiencia sabe para qué sirve el medicamento y no necesita que se lo digan. Un anuncio de recordatorio no contiene información de riesgo sobre el medicamento porque el anuncio no describe la condición tratada o qué tan bien funciona el medicamento.
En otras palabras, los anuncios recordatorios evitan la necesidad de un “equilibrio justo” de información porque no contienen beneficios ni riesgos, solo el nombre del medicamento, que sirve como un “recordatorio” para los consumidores que ya están familiarizados con él.
Estos anuncios no pueden explicar, ni siquiera sugerir, qué hace el medicamento, qué enfermedad trata, cuál es la dosis recomendada o qué tan bien funciona el medicamento; sin embargo, tampoco es necesario que incluyan información sobre los riesgos del medicamento. Estos anuncios deben mencionar la marca del medicamento (si corresponde) y su nombre genérico.
Debido a los límites de caracteres en los anuncios de texto de búsqueda, esta guía se aplica a menudo. A continuación, se muestra un ejemplo de cómo se vería un anuncio recordatorio:

Como se mencionó anteriormente, este anuncio se incluye en la guía de anuncios recordatorios porque contiene el nombre de marca del medicamento, pero no se refiere a la enfermedad o afección que trata. Si lo hiciera, se aplicaría un «equilibrio justo» y sería necesario revelar los riesgos. Obviamente, esto no es posible, ya que sería significativamente más largo que los límites de caracteres de los anuncios de texto estándar.
Es importante tener en cuenta que la guía de anuncios recordatorios no está dirigida únicamente a los esfuerzos de SEM y es aplicable a muchas formas de publicidad.
Limitaciones de espacio
La FDA también ha publicado una guía sobre «Plataformas de Internet / redes sociales con limitaciones de espacio de caracteres. » Esta guía también se puede aplicar potencialmente a los anuncios de texto de búsqueda y, de alguna manera, contradice la política de anuncios recordatorios.
Esta guía reafirma que si una marca elige divulgar un beneficio, entonces debe seguir la información de riesgo. Sin embargo, también explica que si no hay suficientes caracteres para permitir el conjunto completo de información de riesgo, entonces los riesgos deben enumerarse en orden de gravedad.
Aquí está la sección específica que aborda esto:
Como mínimo, una empresa debe comunicar los riesgos más graves asociados con el producto junto con la información sobre los beneficios dentro de la comunicación individual con espacio de caracteres limitado.
A lo largo del documento, la FDA establece que si la compañía farmacéutica siente que no puede presentar con precisión la información de riesgo en el espacio asignado, debería reconsiderar la posibilidad de mostrar su nombre de marca y la información de beneficios en ese bloque de anuncios específico.
Cuando esta guía se aplica a un anuncio de texto, podría parecerse a lo siguiente:
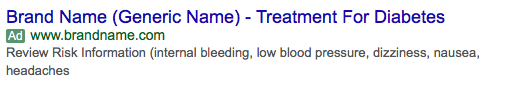
Muchas compañías farmacéuticas no se sienten cómodas aprovechando esto dentro de los esfuerzos de búsqueda pagada y no utilizan este formato. Casi todas las empresas se aseguran de que los anuncios de texto se mantengan dentro de la guía de anuncios recordatorios mencionada anteriormente.
Búsqueda pagada de medicamentos de ‘caja negra’
UNA advertencia en caja aparece en la etiqueta de un medicamento recetado para cualquier medicamento que tenga un riesgo grave asociado. Si una droga tiene un efecto secundario que podría causar la muerte, adicción o lesiones graves, a menudo se etiqueta como «caja negra».
(Nota: los anunciantes son No permitido para usar anuncios recordatorios para medicamentos de «caja negra»).
Durante muchos años, tanto Google como Bing tenían formatos de anuncios específicos para medicamentos de caja negra. Esto incluía una línea adicional de texto, similar a las extensiones de llamada actuales, que decía: “Haga clic para ver la información completa de seguridad y prescripción, incluida una advertencia en un recuadro. Más información.«
La parte de «más información» del anuncio se vincularía a la página de información de seguridad importante (ISI) en el sitio web de la marca. No se podía acceder a este formato de anuncio desde la interfaz de AdWords o Bing Ads y era necesario que lo configuraran los representantes de Google o Bing.
Este formato de anuncio se eliminó a mediados de 2015. Ahora, muchas marcas con advertencias en recuadros utilizan texto similar dentro de sus líneas descriptivas y llevan a los usuarios a una página que contiene información ISI.
Un ejemplo de cómo puede verse un anuncio de caja negra es el siguiente:

Cambios en el uso de URL personalizadas para anunciantes farmacéuticos
Como se mencionó anteriormente, la FDA requiere que enumere la información de riesgo si menciona la enfermedad o la condición que el medicamento trata en un anuncio de texto. Esto provocó que la industria farmacéutica tuviera algunos problemas al intentar que un anuncio de texto fuera relevante para una consulta de búsqueda.
Si alguien buscara medicamentos para la insuficiencia cardíaca y usted quisiera incluir el término “medicamento para la insuficiencia cardíaca” en su anuncio, no podrá hacerlo a menos que revele los riesgos o elimine la marca del medicamento. Con Google y Bing mostrando la URL de destino dentro de los anuncios, que a menudo tenían una marca, esto causó un gran problema para los anuncios de marca.
Para evitar este problema, tanto Google como Bing permitían anteriormente que las marcas farmacéuticas utilizaran URL personalizadas. Básicamente, se trataba de URL sin marca que redirigían a un sitio web de marca. Por ejemplo, www.heartfailuremeds.com redirigiría a www.brand.com. De esta manera, el anuncio no mostraría el nombre de la marca, sino que mostraría www.heartfailuremeds.com en su lugar. Esta práctica, por supuesto, va en contra de las regulaciones para todos los anunciantes fuera de la industria farmacéutica.
A principios de 2016, Google eliminó esta opción, ya que calificaron la práctica como engañosa para los buscadores. Ahora, los anunciantes pueden utilizar un conjunto selecto de «opciones de URL visible».
Actualmente, los anunciantes farmacéuticos pueden elegir entre lo siguiente en AdWords:

Este fue un tema candente dentro de la comunidad SEM en 2016, ya que muchos expertos en PPC se sorprendieron de que Google permitiera a los anunciantes ejecutar algo que no está disponible para ninguna otra industria.
El proceso de revisión legal
Cada compañía farmacéutica tiene un equipo legal y regulatorio interno responsable de revisar una gran cantidad de materiales. Desde sitios web y folletos en la oficina hasta videos y anuncios SEM, todos los materiales de marketing pasan por un riguroso proceso de revisión.
Un problema potencial con el que se encuentran las agencias es cómo diferentes empresas, e incluso diferentes revisores dentro de la misma empresa, interpretan las directrices de la FDA. Un proceso o enfoque de los anuncios de texto que funciona para un cliente puede no ser aceptable para otro.
Como práctica recomendada, trabajar junto con los equipos legales y regulatorios para asegurarse de que comprende sus procesos internos y, al mismo tiempo, ayudarlos a educarlos sobre el canal específico que administra puede ayudar a que el proceso sea lo más fluido posible.
Trabajando con los motores
Hacer despegar una nueva campaña farmacéutica de SEM es bastante difícil cuando tienes que pasar por los obstáculos legales y regulatorios, pero también hay pasos adicionales que se deben tomar con los motores de búsqueda.
Desafortunadamente, no puede simplemente configurar una nueva campaña y ponerla en funcionamiento de inmediato. Cuando se marca como una marca farmacéutica, el sitio web al que se dirige el tráfico debe incluirse en la lista blanca internamente en los motores para calificar para que una campaña se active. Sin esto, los anuncios se rechazarán de inmediato.
Afortunadamente, tanto Bing como Google tienen equipos dedicados que comprenden completamente las reglas y regulaciones farmacéuticas. Al igual que en otras industrias, el gasto es un factor para recibir apoyo dedicado. En algunos casos, las empresas farmacéuticas de nueva creación más pequeñas con un gasto histórico bajo o nulo tendrán que utilizar la línea directa de AdWords para poner en marcha sus campañas.
Las opiniones expresadas en este artículo pertenecen al autor invitado y no necesariamente a El Blog informatico. Los autores del personal se enumeran aquí.
